Un cadre de McKinsey confronté à des questions sur les opioïdes et les conseils de la FDA
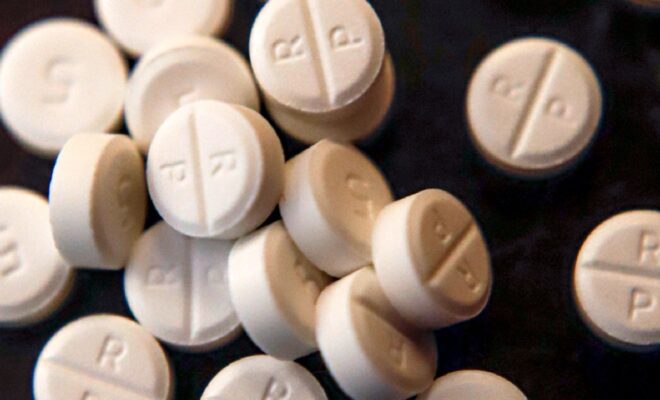
Le cadre supérieur de la société de conseil internationale McKinsey & Company doit répondre mercredi aux questions du Congrès sur le travail de la société pour les régulateurs de santé américains, alors même qu’elle conseillait les fabricants de médicaments opioïdes sur la façon de stimuler les ventes de leurs analgésiques sur ordonnance.
L’audition devant une commission de la Chambre des représentants fait partie d’une enquête en cours sur le rôle de McKinsey dans la crise des opioïdes aux États-Unis, qui a été liée à plus de 500 000 décès par surdose d’analgésiques sur ordonnance et de drogues illicites comme le fentanyl.
L’entreprise a été condamnée pour son travail de conseil auprès des fabricants d’opioïdes, bien qu’elle n’ait admis aucun acte répréhensible.
Les membres de la commission de la Chambre des représentants chargée de la surveillance et de la réforme vont interroger le principal associé de McKinsey, Bob Sternfels, sur les révélations selon lesquelles la société a permis à des consultants travaillant pour Purdue Pharma, fabricant d’OxyContin, de conseiller simultanément la Food and Drug Administration, l’agence chargée de superviser la sécurité des médicaments.
Un rapport préliminaire de la commission a révélé que 22 consultants de McKinsey ont travaillé à la fois pour la FDA et pour un fabricant d’opiacés sur une période de dix ans. Selon l’examen par la commission de milliers de documents de l’entreprise, des membres du personnel de McKinsey ont conseillé la FDA sur la révision de son approche de la sécurité des médicaments.
Pendant ce temps, les consultants de McKinsey ont recommandé des « prix en espèces » et une « reconnaissance inégalée » pour les meilleurs représentants des ventes d’OxyContin afin d’augmenter les ventes de Purdue, selon une présentation stratégique de 2013 publiée mercredi.
« Les conflits et la conduite de McKinsey sont parmi les pires que j’ai vus au cours de mes années dans le gouvernement », dira la présidente Rep. Carolyn Maloney, D-N.Y., au panel, selon les remarques préparées.
Le rapport, rédigé par la majorité démocrate de la commission, suggère que le travail de McKinsey « semble potentiellement » avoir violé les règles de passation des marchés fédéraux qui exigent la divulgation des conflits d’intérêts potentiels.
Sternfels dira au comité que le travail de McKinsey pour la FDA s’est concentré sur le « soutien organisationnel », et non sur les « normes de sécurité des médicaments elles-mêmes », selon le témoignage préparé. Il citera également des exemples où McKinsey a divulgué à la FDA son travail pour des fabricants de médicaments opioïdes.
Les enquêteurs du Congrès ont également trouvé des exemples de McKinsey vantant ses liens avec la FDA lorsqu’il sollicitait des services de conseil auprès de fabricants de médicaments. La société a également soumis des conseils sur la gestion de l’épidémie d’opioïdes à des membres de l’administration Trump, notamment à l’ancien secrétaire à la santé et aux services sociaux Alex Azar, selon le rapport. Il n’est pas clair si les informations ont eu un effet sur la politique fédérale.
Pendant des décennies, McKinsey a été la société de conseil aux entreprises la plus importante, conseillant bon nombre des plus grandes entreprises du monde sur la stratégie et les opérations. La société a également fait des percées dans le conseil aux gouvernements, recevant près d’un milliard de dollars de contrats fédéraux.
Le Comité de surveillance a examiné le travail de McKinsey sur trois douzaines de contrats de la FDA d’une valeur de plus de 65 millions de dollars, s’étendant de 2008 à 2021.
Lors d’une autre audition au Sénat mardi, le directeur du centre des médicaments de la FDA a déclaré aux législateurs que le travail de McKinsey concernait « la conception organisationnelle et n’impliquait pas de participation à la réglementation des produits ». L’agence n’a actuellement aucun contrat avec McKinsey.
Le rapport de la Chambre n’a pas conclu que les conseils de McKinsey à la FDA ont permis d’alléger la réglementation de l’OxyContin ou de tout autre opioïde.
Pendant des années, la FDA a tenté de décourager les médecins de prescrire excessivement ces médicaments, principalement en ajoutant des avertissements supplémentaires à leur étiquetage. Les prescriptions ont chuté par rapport à leur pic de 2012, mais principalement en raison des nouvelles limites de prescription imposées par les gouvernements des États et les collectivités locales, les assureurs et les systèmes hospitaliers.
Depuis l’annonce de l’accord de 600 millions de dollars sur les opioïdes, McKinsey dit qu’il a revu la manière dont il sélectionne ses clients et ne consulte plus les fabricants de médicaments opioïdes.
——
Geoff Mulvihill, rédacteur de l’AP, a contribué à cette histoire depuis Cherry Hill, New Jersey.